I. TUJUAN
Setelah menyelesaikan eksperimen ini mahasiswa diharapkan dapat :
1.Menjelaskan reaksi esterifikasi yang terjadi pada senyawa asam salisilat.
2.Terampil dalam cara kerja pembuatan dan pemurnian aspirin dari asam salisilat.
3.Terampil dalam cara kerja dan teknik-teknik kristalisasi zat organik.
II.LANDASAN TEORI
Awalnya terinspirasi oleh sakit artritis yang diderita ayahnya, Hoffmann, seorang berkebangsaan Jerman mensintesis suatu senyawa bernama asam asetil salisilat (aspirin). Dengan senyawa ini Hoffmann dapat mengobati ayahnya tanpa mengakibatkan iritasi perut yang parah seperti efek samping obat artritis pada masa itu. Itulah salah satu fungsi aspirin yang dicobakan pada praktikum ini. Fungsi aspirin lainnya adalah sebagai pereda demam dan meringankan reumatik.
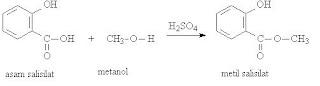
Aspirin dibuat dengan mereaksikan asam salisilat dengan anhidrida asam asetat menggunakan katalis H2SO4 pekat sebagai zat penghidrasi. Asam salisilat adalah asam bifungsional yang mengandung dua gugus –OH dan –COOH. Karenanya asam salisilat ini dapat mengalami dua jenis reaksi yang berbeda. Dengan anhidrida asam asetat akan menghasilkan aspirin, sedangkan dengan metanol ekses akan menghasilkan metil salisilat.

Aspirin yang terjadi dapat bereaksi dengan NaHCO3 membentuk garam natrium yang larut dalam air, sedangkan hasil samping berupa polimer tidak larut dalam bikarbonat. Perbedaan sifat ini digunakan untuk pemurnian aspirin.


Kita bisa menggunakan besi(III)klorida untuk menguji kemurnian aspirin. Besi(III)klorida bereaksi dengan gugus fenol membentuk kompleks ungu. Asam salisilat (murni) akan berubah menjadi ungu jika FeCl3 ditambahkan, karena asam salisilat adalah fenol. Jika tidak ada gugus fenol warna larutan tak berubah (kuning).
III. ALAT DAN BAHAN
Alat : Erlenmeyer 250 cc 2 buah, gelas ukur 20 cc dan 100 , termometer 100C, corong hisap lengkap, penangas air, pipet tetes, pengaduk dan benzena untuk rekristalisasi.
Bahan : Asam salisilat 1 gram, anhidrida asam asetat 2,5 ml,asam sulfat pekat 3 tetes dan akuades.
IV.CARA KERJA
A. PEMBUATAN

B. PEMURNIAN


C. REKRISTALISASI

V. DATA PENGAMATAN
Percobaan.
Pengamatan
A.PEMBUATAN
1 g as salisilat + 2,5 ml as cuka anhidrida, Larutan putih keruh
+ 2,5 ml H2SO4 -----> goyangkan, Kuning kotor
panaskan ± 10 mnt (50-60°C) sambil diaduk, Endapan putih
dinginkan (sewaktu-waktu diaduk), sedikit larutan
+ 75 ml akuades, larut sebagian
aduk, larut
saring dengan saringan hisap, filtrat jernih
B.PEMURNIAN
aspirin tak murni + NaHCO3 jenuh, terbentuk gelembung gas
aduk sampai reaksi sempurna, larut (jernih)
saring dengan saringan hisap ….(filtrat), filtrat
1,75 ml HCl pekat + 5 ml air, larutan jernih
+ filtrat (aduk), endapan putih
dinginkan dengan es, kristal (sedikit larutan)
saring dengan Buchner, kristal murni
cuci kristal dengan air es dingin, kristal lebih murni
taruh di gelas arloji, kristal kering
C.REKRISTALISASI
larutkan kristal dalam benzena, larut
panaskan dengan penangas, larut (jernih)
saring, filtrat
keringkan di oven, terbentuk kristal murni = 0,06 g
VI. PERHITUNGAN
Dalam percobaan digunakan asam salisilat sebanyak 1 g, sehingga mol asam salisilat dapat dihitung, yaitu 1/138 = 0,007 mol. Reaksinya adalah sbb :

Aspirin yang dihasilkan dapat dihitung secara teoritis yaitu mol aspirin dikalikan dengan Mr-nya. Mol aspirin = mol asam salisilat = 0,007 mol. Gram aspirin secara teoritis adalah 0,007 x 180 = 1,26 gram. Dari percobaan dihasilkan aspirin sebanyak 0,06 g, maka rendemennya :
(massa hasil percobaan/massa teoritis) x 100% = (0,06/1,26) x 100% = 4,8%.
VII. PEMBAHASAN
Pada pembuatan aspirin aspirin ini mula-mula dicampurkan 1 g asam salisilat dengan anhidrida asam asetat. Reaksi yang terjadi adalah reaksi esterifikasi yang merupakan prinsip dari pembuatan aspirin. Reaksi esterifikasi tersebut dapat dijelaskan sebagai berikut.

Ester dapat terbentuk salah satunya dengan cara mereaksikan alkohol dengan anhidrida asam. Dalam hal ini asam salisilat berperan sebagai alkohol karena mempunyai gugus –OH, sedangkan anhidrida asam asetat tentu saja sebagai anhidrida asam. Ester yang terbentuk adalah asam asetil salisilat (aspirin). Gugus asetil (CH3CO-) berasal dari anhidrida asam asetat, sedangkan gugus R-nya berasal dari asam salisilat (pada gambar di atas gugus R ada di dalam kotak). Hasil samping reaksi ini adalah asam asetat.
Langkah selanjutnya adalah penambahan asam sulfat pekat yang berfungsi sebgai zat penghidrasi. Telah disebutkan di atas bahwa hasil samping dari reaksi asam salisilat dan anhidrida asam asetat adalah asam asetat. Hasil samping ini akan terhidrasi membentuk anhidrida asam asetat. Anhidrida asam asetat akan kembali bereaksi dengan asam salisilat membentuk aspirin dan tentu saja dengan hasil samping berupa asam asetat. Jadi, dapat dikatakan reaksi akan berhenti setelah asam salisilat habis karena adanya asam sulfat pekat ini.
Tetapi harus diperhatikan bahwa sebelum dipanaskan, reaksi tidak benar-benar terjadi. Reaksi baru akan berlangsung dengan baik pada suhu 50-60°C. Juga pada percobaan ini baru terbentuk endapn putih (aspirin) setelah dipanaskan. Kemudian endapan tersebut dilarutkan dalam air dan disaring untuk memisahkan aspirin dari pengotornya. Tetapi tentu saja dengan penyaringan ini aspirin yang dihasilkan belum benar-benar murni.
Untuk pemurnianya, aspirin tak murni kemudian ditambahi larutan NaHCO3. Reaksinya adalah sebagai berikut :

Aspirin akan larut, sedangkan hasil sampingnya tidak larut, sehingga ketika disaring akan didapatkan filtrat aspirin murni berbentuk larutan jernih. Larutnya aspirin ini juga diikuti oleh timbulnya gelembung gas CO2, membuktikan adanya hasil reaksi aspirin dengan NaHCO3. setelah itu filtrat diaduk dan terbentuk endapan putih. Lalu didinginkan dengan air es membentuk kristal. Kristal akan lebih murni setelah dicuci dengan air es. Selanjutnya kristal dikeringkan dengan cara ditaruh di gelas arloji dan didapatkanlah kristal kering.
Langkah terakhir pada percobaan ini adalah rekristalisasi. Kristal yang kering tadi dilarutkan dalam benzena panas, alu dipanaskan. Benzena digunakan sebagai pelarut karena benzena merupakan pelarut yang baik untuk zat organik. Air tidak bisa digunakan untuk rekristalisasi ini karena air adalah pelarut polar dan aspirin adalah senyawa nonpolar. Setelah itu larutan tadi disaring panas-panas dan filtratnya diambil untuk dikeringkan di oven. Kristal ini merupakan kristal yang benar-benar murni.
Hasil percobaan ini diperoleh aspirin sebanyak 0,06 gram. Hasil ini sangat sedikit karena menurut perhitungan, rendemennya hanya 4,8%. Berkaitan dengan hasil yang minim ini ada beberapa hal yang perlu dibahas disini, yaitu :
1.Benzena yang digunakan untuk rekristalisasi suhunya kurang panas, tetapi hangat.
2.Ketika dilakukan pengeringan di oven, tidak diberi tanda kelompok (hanya diingat tempatnya) sehingga ada (sangat sedikit sekali) kemungkinan kristal diambil kelompok lain.
3.Jika nomor dua tidak terjadi, berarti hasil penyaringan yang berjumlah banyak tidak jadi *.
VIII.KESIMPULAN
1.Aspirin dapat dibuat dengan mereaksikan asam salisilat dengan anhidrida asam asetat dengan adanya H2SO4.
2.Prinsip pembuatan aspirin adalah reaksi esterifikasi.
3.Pelarut organik (seperti benzena) dapat digunakan untuk rekristalisasi senyawa organik.
4.Diperoleh rendemen sebesar 4,8%.
IX.DAFTAR PUSTAKA
Ralp J. Fessenden, Joan S. Fessenden, 1990, Kimia Organik 3rd Edition, Penerbit Erlangga : Jakarta.
Drs. Ersanghono Kusuma, MS, 2003, Sintesis Organik, Jurusan Kimia FMIPA UNNES : Semarang.
Tim Dosen, 2003, Diktat Petunjuk Praktikum Kimia Organik 2, Lab. Kimia FMIPA UNNES : Semarang.
http://homepage.ius.edu/DSPURLOC/C122asp.htm.
http://home.snu.edu/dept/chemistry/syillabi/ARCHIVES/CHEM11~1/Labs__~1/ SYNTHE~1.DOC.
Semarang, 29 Mei 2012
Praktikan
Muh. Khabib
* Penyaringan terakhir (rekristalisasi) dilakukan dua kali. Yang pertama menghasilkan endapan yang banyak dan penyaringan kedua hasilnya sedikit. Tetapi yang jadi kristal alah yang kedua, sementara hasil penyaringan pertama (yang sedikit) tidak jadi.






0 komentar:
Posting Komentar